По отношению их:
- а) к воде;
- б) к кислотам;
- в) к основаниям;
- г) друг к другу.
1. Взаимодействие с кислотными и амфотерными оксидами с образованием соли и воды. Среди указанных веществ СО2 - кислотный оксид.
2NaOH + СО2 = Na2C03 + Н20
20Н + СО2 = СО32- + Н20.
2. Взаимодействие с амфотерными гидроксидами, проявляющими в этом случае свойства кислот; в результате образуется комплексная соль. Zn(OH)2 - амфотерный гидроксид.
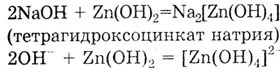
3. Взаимодействие с кислотами с образованием соли и воды. Взаимодействие основания с кислотой называется реакцией нейтрализации. Среди перечисленных в задании веществ две кислоты: сильная нелетучая серная кислота H2S04 и слабая летучая серо водородная кислота H2S.
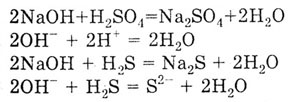
Следует помнить, что слабые электролиты пишут в молекулярном виде в сокращенных ионных уравнениях реакций.
4. Взаимодействие с растворимыми солями с образованием новой соли и нового основания, причем одно из образовавшихся веществ должно выпадать в осадок. CuSO4 - растворимая соль, NaOH — щелочь.
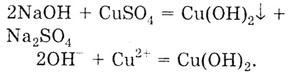
5. Щелочи могут взаимодействовать с некоторыми металлами в растворах. К числу таких относятся Аl и Zn, которые проявляют амфотерные свойства. Среди указанных в задании веществ есть алюминий, с которым происходит следующая реакция: алюминий реагирует с водой, образуя гидроксид алюминия Аl(ОН)3 и водород Н2. Так как Аl(ОН)2 — амфотерный гидроксид, то в присутствии щелочи NaOH он проявляет свойства слабой кислоты, поэтому растворяется в щелочи с образованием комплексной соли:
2А1 + 6Н,0 = 2Аl(ОН)3
+ ЗН2![]()
2Аl(ОН)3 + 2NaOH = 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Задача. Напишите уравнения реакций в молекулярном и ионном виде, доказывающих амфотерный характер:
- а) гидроксида алюминия;
- б) оксида цинка;
- в) цинка.
Решение. Чтобы выполнить это задание, необходимо знать, что доказательством амфотерности веществ является взаимодействие их как с кислотами, так и с основаниями.
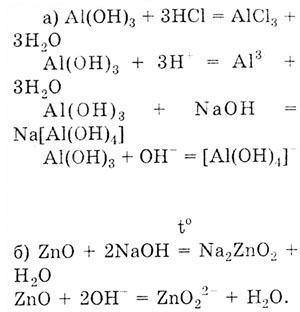
В этой реакции оксид цинка проявляет свойства кислотного оксида. Кислотному оксиду ZnO соответствует кислота H2Zn02 (мысленно прибавили воду). Поэтому образуется соль цинковой кислоты - Na2ZnO2 - цинкат натрия.
ZnO + 2НС1 = ZnCl2 + Н20
ZnO + 2Н+ = Zn2+ + Н20.
В этой реакции ZnO проявляет свойства основного оксида. Переход цинка в раствор в виде катиона Zn2+ является свидетельством основных свойств оксида цинка при взаимодействии с кислотой.
в) Цинк реагирует как с кислотой, так и со щелочью в растворе, что является доказательством амфотерности.
Zn + 2НСl = ZnCl2
+ Н2![]()
Zn + 2NaOH + 2Н20
= Na2[Zn(OH)4]
+ Н2![]()
Задача. Получите оксид меди двухвалентной всеми известными способами.
Решение. а) взаимодействие меди с кислородом при нагревании:
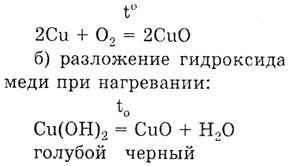
в) разложение соли летучей кислоты, например, малахита при прокаливании:
